Barkod
Barkod
GS1 standardi
GS1 standardi
Proizvodi
Jedinični proizvod i transportna kutija
Varijabilna mjera (CRO-SCAN)
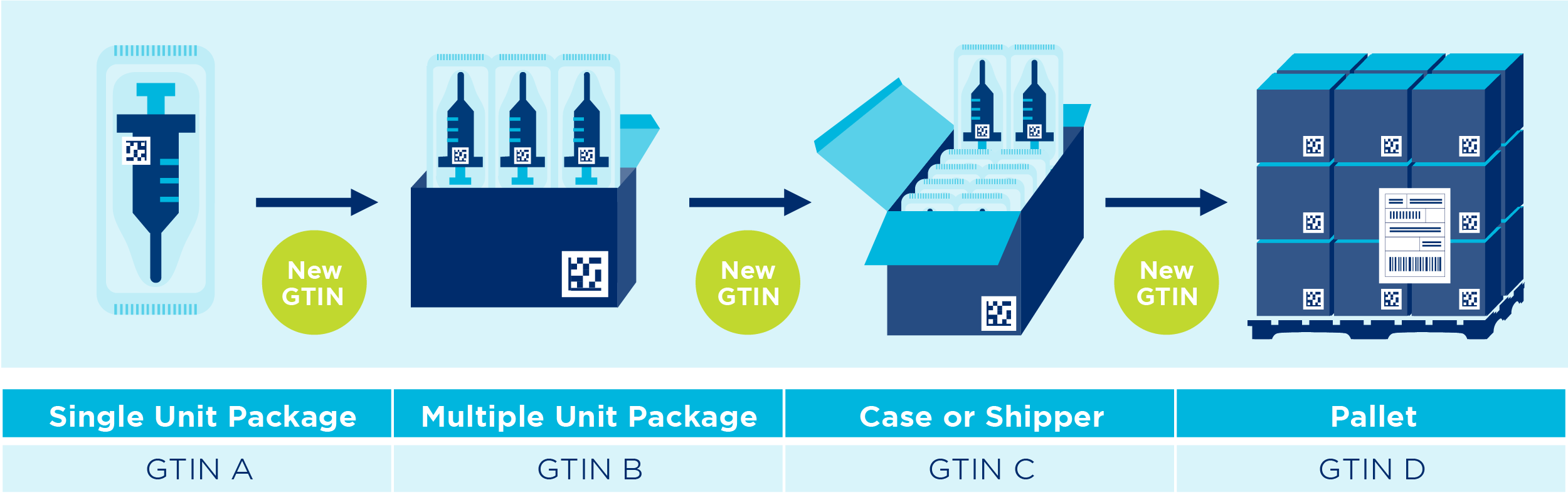
Proizvodi s promjenjivom mjerom (vagani)
Palete
SSCC, GS1-128 i logistička naljepnica
Lokacije
GLN - Globalni lokacijski broj
Online trgovine
Prodaja na online platformama kao što su Amazon, eBay, AliExpress, Google Shopping
Servisi
Servisi





 UDI (engl. Unique Device Identification) je sustav za jedinstvenu identifikaciju medicinskih proizvoda kojeg koriste različiti globalni regulatori, a koji povećava sigurnost pacijenata i efikasnost upravljanja troškovima i zalihama, te omogućuje bolje upravljanje povlačenjima proizvoda i smanjuje mogućnost nastanka ljudske pogreške.
UDI (engl. Unique Device Identification) je sustav za jedinstvenu identifikaciju medicinskih proizvoda kojeg koriste različiti globalni regulatori, a koji povećava sigurnost pacijenata i efikasnost upravljanja troškovima i zalihama, te omogućuje bolje upravljanje povlačenjima proizvoda i smanjuje mogućnost nastanka ljudske pogreške.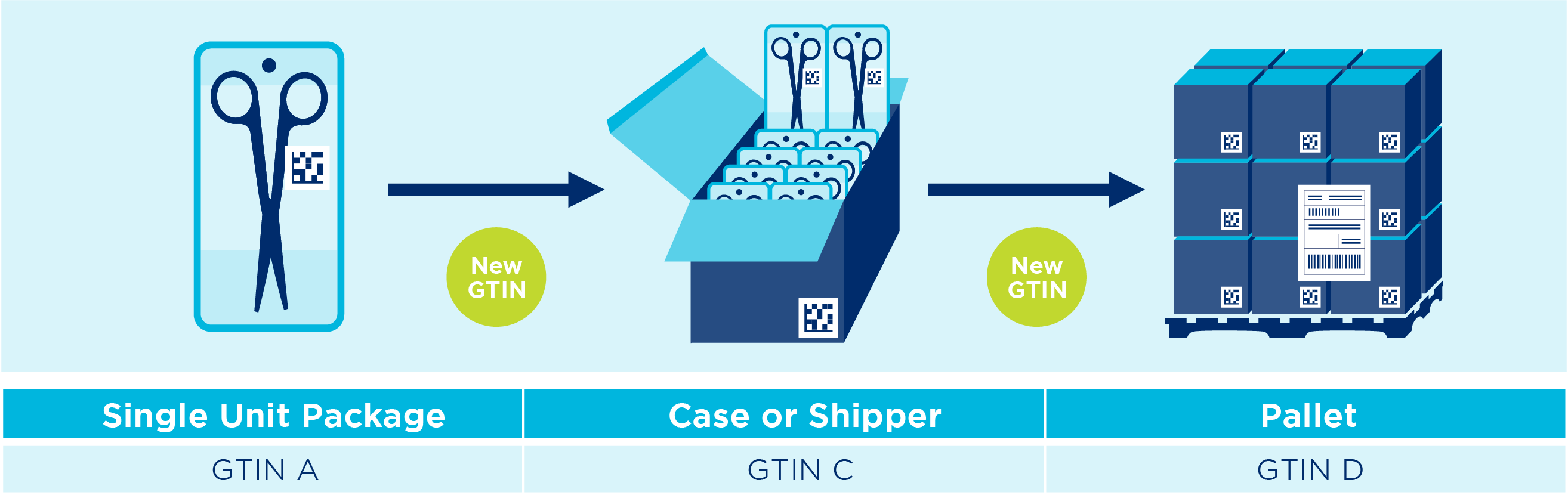
 Uredba EU 2017/745 (Medical Device Regulation - MDR) i Uredba EU 2017/746 (In-Vitrodiagnostic Regulation - IVDR) uspostavljaju moderniji i snažniji zakonodavni okvir EU-a za medicinske proizvode u cilju osiguravanja bolje zaštite javnog zdravlja i sigurnosti pacijenata. Novo zakonodavstvo usmjereno je na poboljšanje kvalitete, sigurnosti i pouzdanosti medicinskih proizvoda, povećanje transparentnosti informacija za korisnike, kao i na poboljšanje praćenja sigurnosti primjene i nadzora nad tržištem medicinskih proizvoda.
Uredba EU 2017/745 (Medical Device Regulation - MDR) i Uredba EU 2017/746 (In-Vitrodiagnostic Regulation - IVDR) uspostavljaju moderniji i snažniji zakonodavni okvir EU-a za medicinske proizvode u cilju osiguravanja bolje zaštite javnog zdravlja i sigurnosti pacijenata. Novo zakonodavstvo usmjereno je na poboljšanje kvalitete, sigurnosti i pouzdanosti medicinskih proizvoda, povećanje transparentnosti informacija za korisnike, kao i na poboljšanje praćenja sigurnosti primjene i nadzora nad tržištem medicinskih proizvoda. Američki zakonodavac USA FDA (
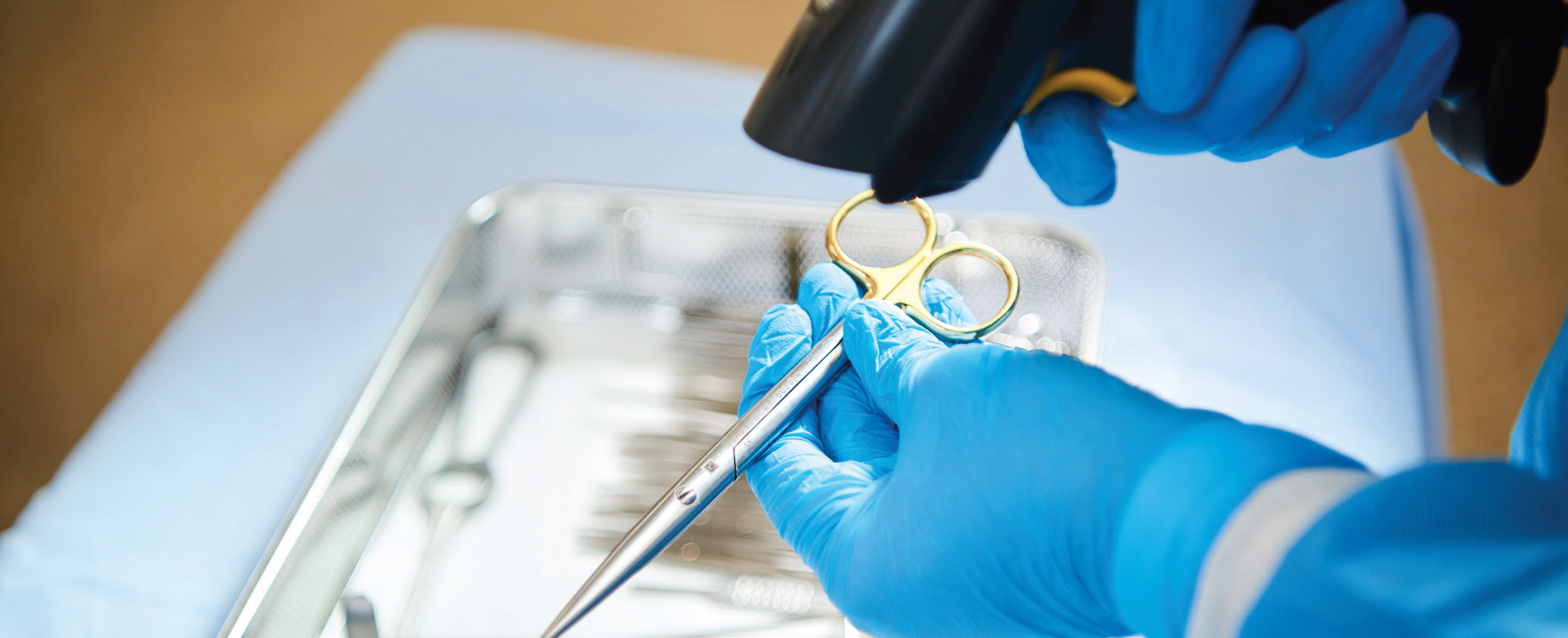
Američki zakonodavac USA FDA ( GS1 DataMatrix simbologija može se izravno primijeniti na različite vrste medicinskih proizvoda, čime se postiže efikasna identifikacija i praćenje instrumenata od korištenja do sterilizacije i pohrane. Osnovna karakteristika 2D kodova je mogućnost zapisa brojnih informacija na maloj površini i zato je ta vrsta simbologije najprimjerenija za instrumente, čija je površina ograničena.
GS1 DataMatrix simbologija može se izravno primijeniti na različite vrste medicinskih proizvoda, čime se postiže efikasna identifikacija i praćenje instrumenata od korištenja do sterilizacije i pohrane. Osnovna karakteristika 2D kodova je mogućnost zapisa brojnih informacija na maloj površini i zato je ta vrsta simbologije najprimjerenija za instrumente, čija je površina ograničena.